来凯医药在2024 ESMO大会上公布LAE002 (afuresertib) 治疗HR+/HER2- 乳腺癌Ib期临床优异数据
- 58.1%的受试者伴有PIK3CA/AKT1/PTEN通路改变,64.5% 受试者既往接受过CDK4/6抑制剂治疗
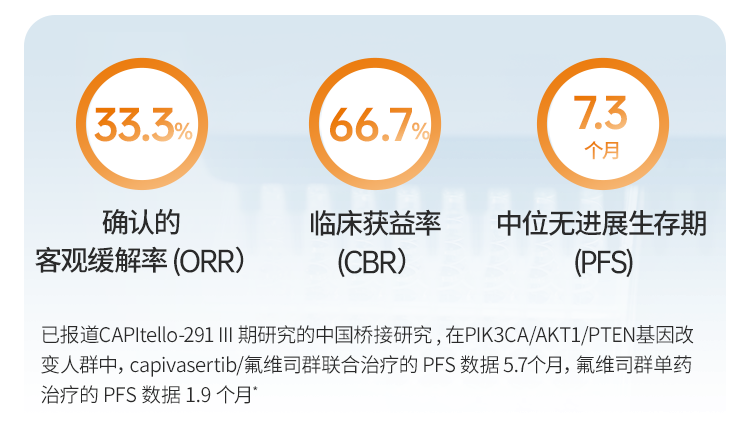
- 确认的ORR为33.3%,临床获益率 66.7%,PFS为7.3个月
- 已报道的CAPItello-291 III 期研究的中国桥接研究,在PIK3CA/AKT1/PTEN通路改变人群中,capivasertib/氟维司群联合治疗组PFS 数据 为5.7个月,氟维司群单药治疗的 PFS 数据 1.9 个月
- 徐兵河院士牵头,III期临床试验AFFIRM-205进展顺利、比原计划提前
2024年9月19日 ——在刚刚举行的2024 年欧洲肿瘤内科学会 (ESMO) 大会上,来凯医药 (2105.HK) 公布了其创新产品 LAE002(afuresertib,一种口服 AKT 抑制剂)联合氟维司群(下简称“联合疗法”),用于标准治疗失败的局部晚期或转移性HR+/HER2-乳腺癌患者Ib期研究的最终数据。在18 位 PIK3CA/AKT1/PTEN 变异的乳腺癌患者中,中位无进展生存期 (PFS)为 7.3个月。
该 Ib 期临床试验是一项单臂、开放标签研究,旨在评估“联合疗法”对 HR+/HER2-乳腺癌患者的疗效和安全性,这些患者曾接受 1-2 线内分泌治疗(联合或不联合 CDK4/6 抑制剂(≤1 线)和/或 ≤1 线化疗)后出现进展。
截至2024年8月27日,该Ib研究共入组31名受试者,含28位中国和3位美国受试者,受试者的中位年龄为54岁。其中71.0%的受试者接受过1线治疗,29.0%的受试者接受过二线治疗。18位患者伴有PIK3CA/AKT1/PTEN改变,占受试者的58.1%;入组患者中64.5%既往接受过CDK4/6抑制剂治疗, 中位随访时间为17.3个月。在中美31位全受试者人群、以及伴有PIK3CA/AKT1/PTEN改变的亚组人群中,该疗法都显示出显著的抗癌疗效和良好的耐受安全性。
在 18 名 PIK3CA/AKT1/PTEN 变异患者中:
来凯医药已于2024 年 5 月在中国启动了后续 III 期关键临床试验 AFFIRM-205,由中国医学科学院肿瘤医院徐兵河院士牵头,用于治疗PIK3CA/AKT1/PTEN改变的HR+/HER2-乳腺癌患者。目前项目进展顺利,比计划的时间表提前。
“此次ESMO大会上公布的联合疗法Ib期数据,特别是对伴有PIK3CA/AKT1/PTEN改变受试者显示出积极的疗效和安全性,公司对AFFIRM-205取得积极成果和递交药品上市申请充满信心。”来凯医药董事会主席兼首席执行官吕向阳博士表示,“目前III期临床正在全国各中心全速、高效推进,我们对此深感振奋,并将竭尽全力、尽快惠及患者。”
*ESMOAsia2023 capivasertib+fulvestrant for patients with aromatase inhibitor-resistant HR-positive/HER2-negative advanced breast cancer: Phase3 CAPItello-291trial Chinese cohort
- 完 –
关于LAE002 (afuresertib)
LAE002 (afuresertib)是全球仅有的两种处于晚期临床开发阶段的针对乳腺癌及前列腺癌的AKT抑制剂之一。
LAE002 (afuresertib)是一种AKT强效抑制剂,抑制所有三种AKT亚型(AKT1、AKT2及AKT3),根据公开数据,与其他AKT抑制剂相比,LAE002 (afuresertib)具有疗效更高、药效更好、肿瘤抑制暴露更显著、安全性更佳等多项优势。Capivasertib是阿斯利康首个获批的AKT抑制剂,于2023年11月经FDA批准用于HR+/HER2-乳腺癌。
在推进联合疗法的过程中,来凯医药团队具有强大的执行力和经验,证明我们能够充分释放产品管线的临床价值。LAE002 (afuresertib)与氟维司群的联合疗法试验对此前接受过前线标准内分泌/ 抗雌激素疗法(包括抗CDK 4/6抑制剂)治疗失败的HR+/HER2-乳腺癌患者凸显出重大的临床价值。这是一项未满足的医疗需求,具有巨大的市场潜力。
关于HR+/HER2-(激素受体阳性、人表皮生长因子受体2阴性)乳腺癌
世界卫生组织国际癌症研究机构(IARC)最新发布的数据显示,2022年全球乳腺癌新发病例数预估达229万人,是女性中的“全球第一大癌”,预估有66.6万患者因此死亡。IARC数据还显示,乳腺癌位居中国女性癌症发病第二位,2022年新发病例预估35.7万。
在美国所有乳腺癌患者中,约69%属于HR+/HER2-(激素受体阳性、人表皮生长因子受体2阴性),中国患者中这一类分子亚型比例为62%。尽管大多数此类乳腺癌患者初始可从一/二线内分泌+CDK4/6抑制剂和/或者化疗中获益,但一段时间后,大部分可能会产生耐药,导致治疗失败,患者亟需耐药后的新型治疗选择。
1 Global Cancer. IARC. http://gco.iaic.fr/
2 Global Cancer. IARC. http://gco.iaic.fr/
3 Cancer Stat Facts: Female Breast Cancer Subtypes; SEER 22 2016–2020
4 Breast cancer subtypes and survival in Chinese women with operable primary breast cancer. Chin J Cancer Res, 2011. 23(2): p. 134-9.
关于来凯医药
股份代码:2105.HK
来凯医药成立于2016年,是一家以科学为驱动、处于临床阶段的生物医药科技公司,致力于为全球肿瘤、代谢疾病及肝纤维化患者带来新型疗法。
截至2024年6月30日,来凯医药围绕LAE102、LAE002(afuresertib)、LAE001及LAE005启动了七项临床试验,以解决肥胖症及肿瘤领域未被满足的医疗需求。
LAE102是来凯自主研发针对ActRIIA的单克隆抗体。临床前研究显示,可增加肌肉并减少脂肪。LAE102已获得中国和美国针对肥胖适应症的新药临床试验(IND)批准,I期临床研究正在中国全速推进。
阻断Activin-ActRII通路可促进肌肉再生和减少脂肪。来凯团队在这一特定领域积累了丰富的经验及深厚的专业知识,并正在开发更多的候选药物(LAE103、LAE123等),以最大限度地发挥靶向ActRII受体的价值。
在肿瘤领域,来凯已经建立全面的候选药物组合,覆盖乳腺癌、前列腺癌、卵巢癌及PD-1/PD-L1耐药实体瘤等。LAE002(afuresertib)是一种AKT强效抑制剂,抑制所有三种AKT亚型(AKT1、AKT2及AKT3),也是全球仅有的两种处于晚期临床开发阶段的针对乳腺癌及前列腺癌的AKT抑制剂之一。目前来凯医药针对HR+/HER2-乳腺癌III期关键研究(AFFIRM-205)已全面启动。
2023年6月29日,来凯医药在香港联合交易所有限公司(“香港交易所”)主板上市,股份代码:2105.HK。
如需了解更多公司信息,请访问http://www.laekna.com
前瞻性声明
本新闻稿有若干前瞻性陈述,该等前瞻性陈述并非历史事实,乃基于来凯医药的现有看法、假设和期待而对未来事件做出的预测,通常会使用“将”、“可能”、“期望”、“相信”、“计划”、“预估”、“预测“及其他类似词语进行表述。尽管本公司相信所做的预测合理,但是基于未来事件固有的不确定性,我们的实际未来业绩或表现可能与预测有重大差异。因此,您应注意,依赖任何前瞻性陈述可能导致已知及未知的重大风险和不确定性。本新闻稿载有的所有前瞻性陈述需参照本部分所列的提示声明。本新闻稿所载的所有信息仅以截至本新闻稿做出当日为准,且仅基于当日的假设,除法律有所规定外,本公司概不承担义务对该等前瞻性陈述更新。
联系来凯
投资者关系ir@laekna.com
业务发展bd@laekna.com

关注 来凯医药 领英公众号







